El proyecto del inoculante ARVAC Cecilia Grierson contra el COVID, entrará en su última etapa de estudio, apuntando a que la reguladora local ANMAT apruebe esta fórmula durante 2023. Los próximos pasos.
Los expertos a cargo de la vacuna bivalente argentina contra el COVID-19 “ARVAC Cecilia Grierson” iniciarán el lunes 6 de febrero la Fase II/III del proceso, dándole forma a la etapa final con la vacunación del primer voluntario de esta etapa del estudio clínico. Al mismo tiempo, siguiendo las recomendaciones de especialistas y de agencias de salud locales e internacionales. comenzará la evaluación de una nueva versión bivalente de la fórmula, con un antígeno de Ómicron BA.4 y BA.5.
Esta vacuna es desarrollada íntegramente en el país por científicos del CONICET, de la Universidad Nacional de San Martín (UNSAM) y del laboratorio Pablo Cassará. El estudio de Fase II/III será realizado en más de 10 sitios de investigación, con la incorporación y el aporte del grupo de trabajo del doctor e investigador Gonzalo Pérez Marc.
Según adelantaron a Infobae desde el laboratorio Pablo Cassará, en esta institución ya cuentan con la capacidad industrial para producir hasta 5 millones de dosis mensuales de antígeno vacunal, y tienen proyectado comenzar su fabricación en paralelo al desarrollo de los mencionados estudios de Fase II/III.
En los primeros días del 2023, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) había autorizado el inicio de los estudios de Fase II/III del proyecto para evaluar la seguridad, tolerabilidad e inmunogenicidad. Cabe recordar que ARVAC es una vacuna proteica producida por biotecnología, una plataforma tecnológica muy segura que se utiliza desde hace décadas en inoculaciones para niños recién nacidos y adolescentes. De hecho, Cassará desarrolló y lanzó al mercado en 1997 la primera vacuna contra la Hepatitis B producida en la región.
 Durante esta etapa se verificarán la tolerabilidad, seguridad e inmunogenicidad de la vacuna.
Durante esta etapa se verificarán la tolerabilidad, seguridad e inmunogenicidad de la vacuna.“Durante la pandemia, Argentina tuvo que esperar a que los productores de vacunas abastecieran a los países en los que estaban instalados. Tener una plataforma propia para la región es muy importante para que eso no vuelva a ocurrir, en caso de que haya una nueva pandemia o que las variantes que circulen en nuestra región no sean las mismas que en el norte”, había resaltado en diálogo con Infobae Juliana Cassataro, bióloga (UNSAM), doctora en Inmunología y líder del equipo UNSAM-CONICET que trabaja en esta vacuna.
Por su parte, otro de los investigadores a cargo de este desarrollo, Juan Manuel Rodríguez, quien es biólogo (UBA), y coordinador del área de I+D de biofármacos del Laboratorio y Fundación Pablo Cassará, le había dicho a este medio: “Este tipo de tecnología (producto basado en proteínas recombinantes) se guarda en la heladera (2 – 8 °C) y puede durar un año; por lo tanto, para la distribución en lugares remotos donde no tienen acceso a un freezer de -70 es sustancial. Y otro tema es que esta plataforma ya tiene la capacidad de manufactura en la región. Ya hay plantas que producen anticuerpos monoclonales y pueden hacerlas a lo largo y ancho del país”.
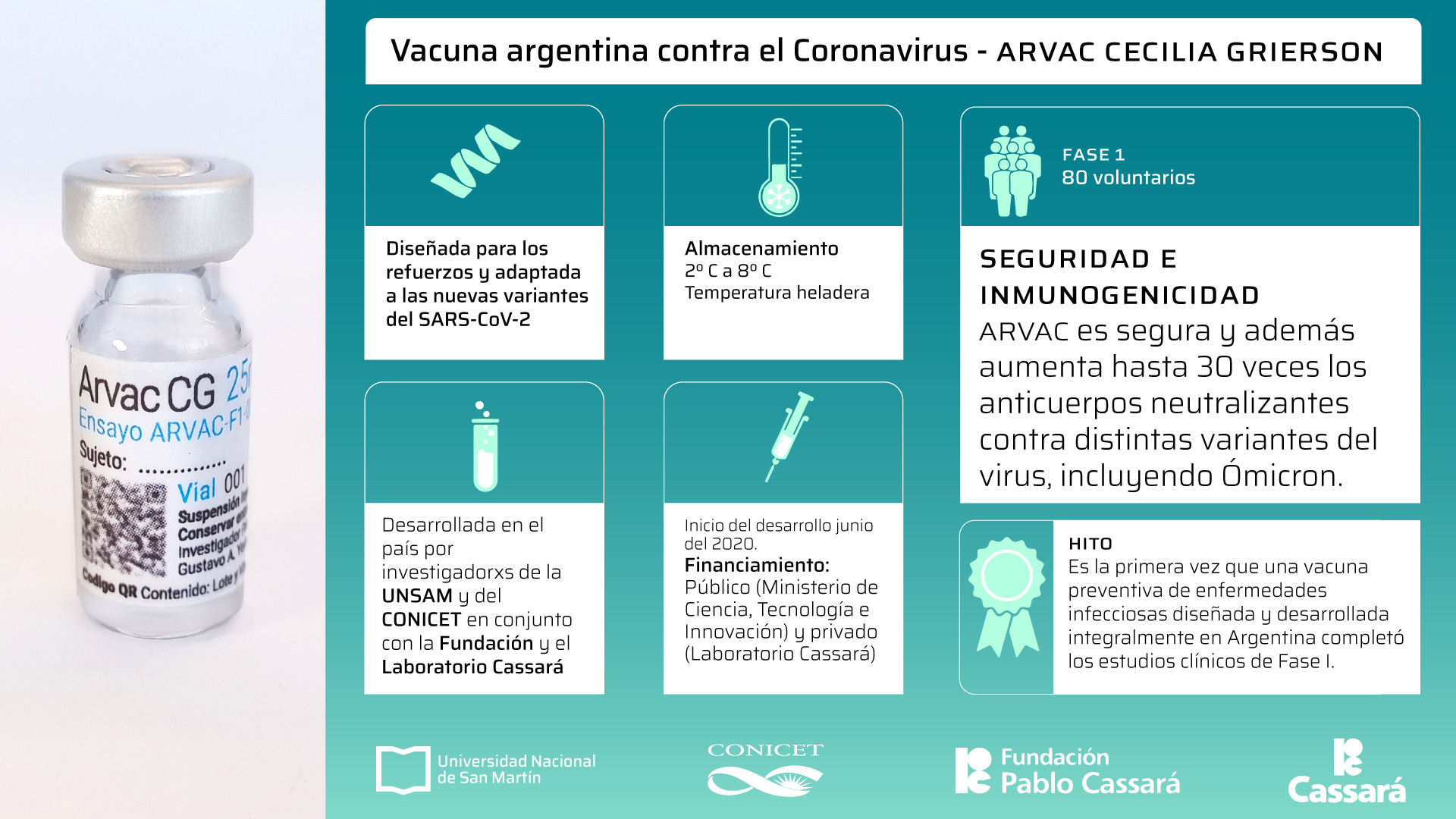 A principios de 2023, la ANMAT había autorizado la Fase II/III de este proyecto
A principios de 2023, la ANMAT había autorizado la Fase II/III de este proyectoDurante el proceso tecnológico a escala industrial de ARVAC, que comenzó en el año 2021, se desarrollaron 5 tecnologías de producción de antígeno en las variantes del SARS-CoV-2 Wuhan, Gamma, Delta, Omicron B1 y Omicron BA.4 y BA.5. En el estudio de Fase I se comprobó que la fórmula es segura y que incrementa hasta 30 veces los anticuerpos neutralizantes contra Wuhan, Gamma y Ómicron. ARVAC está diseñada como vacuna de refuerzo, se puede almacenar y transportar refrigerada entre 2°C y 8 °C y, además, puede actualizarse su principio activo para hacer frente a nuevos sublinajes del virus que escapen a la respuesta inmunológica.
Un logro vital de la ciencia argentina
Este proyecto comenzó con el financiamiento inicial de la Agencia Nacional de Promoción Científica y Tecnológica del Ministerio de Ciencia y Tecnología, y continuó con la inversión del Laboratorio Cassará en el desarrollo tecnológico y en los estudios de Fase I. 4. Es la primera vez que una vacuna contra enfermedades infecciosas diseñada y desarrollada integralmente en Argentina logra completar los estudios clínicos de Fase I.
Jorge Cassará, directivo del laboratorio homónimo, había valorado: “Este es un proyecto que enfoca la capacidad científico-tecnológica argentina en resolver necesidades concretas con alto impacto sanitario y económico. El proyecto va a dejar instalada una plataforma de desarrollo y producción de vacunas recombinantes que podrá ser utilizado para nuevas vacunas en el futuro”.
“La vacuna avanza sólidamente y es un orgullo para la ciencia argentina. Disponer de una vacuna nacional diseñada por nuestras científicas y científicos y producida por una empresa privada representa un caso exitoso de articulación público-privada con impacto en la calidad de vida de las personas”, había agregado el ministro de Ciencia y Tecnología, Daniel Filmus.
En síntesis, en los próximos días comenzará la Fase II/III del proyecto para que, finalmente, la vacuna sea aprobada por la ANMAT durante 2023. Los estudios clínicos en esta etapa “serán realizados en voluntarios adultos previamente vacunados contra el virus SARS-CoV-2″, había informado desde el Ministerio de Salud que lidera Carla Vizzotti. Las personas que quieran participar de esta parte de la investigación como voluntarios deben ser mayores de 18 años de edad, deben estar sanos y haber recibido dos dosis del esquema primario de la vacuna contra COVID-19. A los participantes se les aplicará el esquema de refuerzos de la vacuna en estudio.
fuente: infobae